Miért mellőzzük ezt a hatékony terápiát a rákkezelésében?
A rákkezelésében az egyik új megközelítés a metabolikus utak célzása, amelyeket a rákos sejtek kórosan változott anyagcsere-útvonalai használnak fel. Ez az irány azonban gyakran figyelmen kívül marad, pedig ígéretes lehet a kezelések hatékonyságának növelésében.
A kutatók egyre több bizonyítékot találnak arra, hogy a rákos sejtek anyagcseréje szorosan kapcsolódik a túlélésükhöz és szaporodásukhoz. Ennek ismeretében a metabolikus útvonalak blokkolásával olyan terápiák fejleszthetők ki, amelyek hatékonyabban célozzák meg a rákos sejteket, minimalizálva a káros mellékhatásokat.
Ilyen szerek pl. a sztatinok, a Metformint, a Doxycyclin és a Mebendazolt, melyeket általában nem társítanak egy onkológus fegyvertárához, de olyan anyagcsere-utakon dolgoznak, amelyek közösek a legtöbb daganat növekedésnél.
Ez a gyógyszerkombináció egyidejűleg avatkozik be több fehérjébe vagy jelátviteli útvonalba. Ennek hatása a rákos sejtek elpusztítása, szaporodásuk megakadályozása vagy újraprogramozása, hogy egészséges sejtekhez hasonlóan viselkedjenek.
Együttesen alkalmazva ezek a gyógyszerek megváltoztathatják azoknak a rákbetegeknek a kilátásait, akiknek azt mondták, hogy nincs más lehetőség a betegségük előrehaladásának megállítására. Emellett hatalmas összegeket is megtakaríthat az állam a kemoterápia és immunterápia kezelésekre fordított költségek kiváltával, amelyek hatástalannak bizonyultak a betegek nagy többségének.
Kemoterápiával “gyógyítható” daganatok
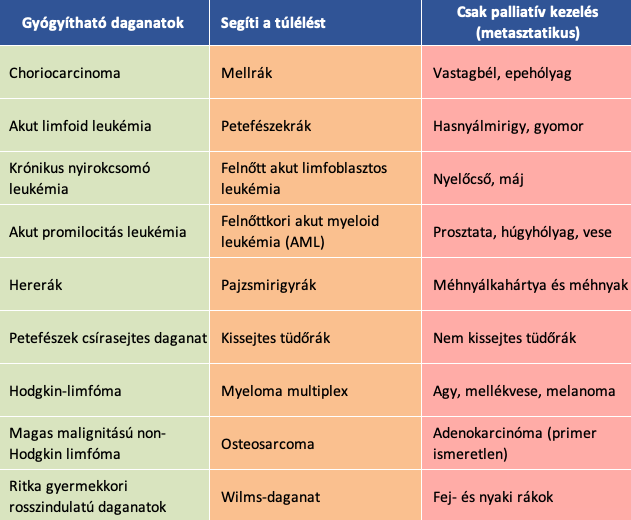
Az Egyesült Államokból származó tanulmányok igazolták, hogy egy antibakteriális kezelés preklinikai modellekben képes gátolni a rosszindulatú daganatok legtöbb típusának növekedését [1]; és hogy a sztatinokat kapó férfi prosztatarákos betegek tovább élnek daganatnövekedés nélkül [2], illetve, hogy a daganatos megbetegedésben szenvedő nők akár 50%-kal kisebb valószínűséggel halnak meg, ha sztatinokat kapnak [3].
Egy korábbi metanalízis a Metformint érintően, 1,5 millió egyénnel, szintén azt mutatta, hogy használói nemcsak jelentős csökkenést tapasztaltak a rák kialakulásának kockázatában, hanem jelentős csökkenést is mutatott a betegség allatt és után bekövetkező halálozásban [4].
Számos más gyógyszerek is rendelkezik ugyanezen előnyökkel, de eddig a fenti négy szer keltette fel a legnagyobb érdeklődést. A hatásmechanizmusukat jól tanulmányozták és jelenleg nincs olyan bizonyíték, amely arra utalna, hogy károsodást vagy kellemetlen mellékhatásokat okozhatnának.
Metformin
Számos kísérlet kimutatta, hogy a Metformin, amelyet rutinszerűen alkalmaznak a cukorbetegség kezelésére, gátolja a ráksejtek kialakulását. A pontos mechanizmusok nem ismertek, és a gyógyszer különböző hatásokkal bírhat különböző ráktípusokban.
Vannak bizonyítékok arra, hogy a Metformin blokkolja a Stat3 nevű hibás útvonalat, amely egy fő fehérje, amely szabályozza más, a ráksejtekben fontos jelátviteli molekulák termelését [5].
A Metformin megváltoztatta a hibás Bcl-2 és Bcl-xL hatását is, amelyek egészséges sejtekben segítenek az apoptózist szabályozni, de ráksejtekben halhatatlanságot biztosítanak [6]. Ezen kívül más vizsgálatok kimutatták, hogy a Metformin az apoptózist kiváltva gátolja a sejtosztódást szabályozó mTOR és Ras fehérjéket [7], és károsítja a ráksejtek számára létfontosságú glükózanyagcserét, blokkolva a hexokináz l/ll enzimek funkcióját [8].
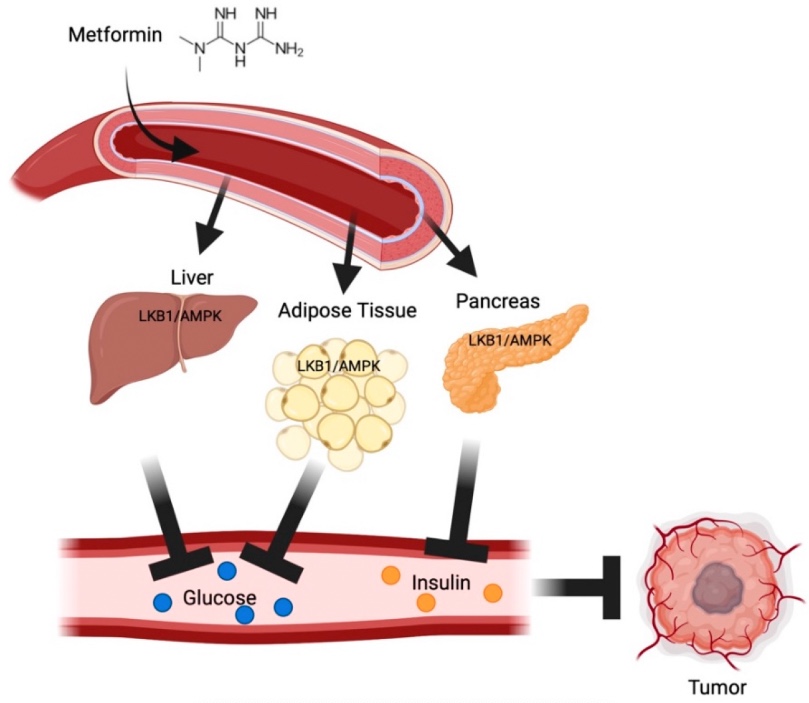
Egyéb tanulmányok azt is kimutatták, hogy a metformin aktiválja az endoproteázok caspase családját, amelyek peptide kötéseket bontanak le a molekulákban, és a sejthalál szabályozásában is részt vesznek [9].
Sztatinok
Ez a gyógyszercsoport a lakosság 13%-ának rutinszerűen felkínált gyógyszere, elsősorban a vérkoleszterin csökkentésére és a szívbetegség kockázatának csökkentésére. Azonban, hasonlóan a metforminhoz, a sztatinok is úgy tűnik, hogy megváltoztatják a gének kifejeződését, amelyek a ráksejtekben az életet támogató és a halált elősegítő fehérjék egyensúlyát szabályozzák, és számos előnnyel járhatnak a ráksejtek elpusztításában.
Az egyik elsődleges hatás az, hogy a sztatinok blokkolják a koleszterint termelő HMG CoA enzim aktivitását, ami azt jelenti, hogy kevesebb koleszterin áll rendelkezésre a gyorsan proliferáló daganatok új sejtfalainak létrehozásához.
A tanulmányok azt mutatták, hogy a sztatinok újraaktiválják a kaszpázok, és nem csak a hibás Bcl-xL-en, hanem egy másik fehérjén is, amely részt vesz a normál apoptózisban, Bax-nek nevezett fehérjén [10].
Ezen kívül felerősítik a PPARGamma termelését is, egy másik fehérjét, amely programozza a sejthalált, amelyet a gyorsan replikálódó daganatok kiiktatnak [11]; és csökkentik a sejtfelszíni GLUT-1 glükózreceptorok számát, ezzel csökkentve a ráksejt aktivitását a rendelkezésre álló energia korlátozásával [12].
Doxycyclin
Egy akné rutinszerű kezelésére szolgáló antibiotikum, a Doxycyclin azon gyógyszerek egyike, amelyek hasznot hozhatnak a ráknak. Lebontja a mitokondriumokat, az energiát adó sejtalkotókat, amelyeket a túlterhelt ráksejtekben találnak [13]. Blokkolja a metalloproteinázok aktivitását is, amelyek egyébként részt vennének a sejtek közötti mátrix lebontásában, lehetővé téve az egyes ráksejtek számára, hogy szabadon mozogjanak, és új, áttétes ráknövekedést okozzanak a test különböző részein.
A kiegészítő hatás az, hogy a Doxycyclin hat a hibás Bcl-xL-en is, és újraaktiválja a kaszpáz-3 és -9-et a ráksejtek elpusztításának kiváltásához [14].
Mebendazol
Eredetileg parazitaellenes kezelésére kifejlesztett vegyület, a Mebendazol az abnormális ráksejtek sejtmikrotubulus-képzésének zavarásán keresztül működik, amely akkor következik be, amikor a sejt osztódni próbál. Mint a terápiás megközelítésben alkalmazott három másik vegyület, a Mebendazol is inaktiválja a Bcl-2-t és aktiválja a kaszpázokat az apoptózis elősegítése érdekében a ráksejtekben, valamint a citokróm c felszabadulását, amely szintén bebizonyosodott, hogy az apoptózist kiváltja a malignus sejtekben [15].
Alacsony dózisú kemoterápia kombinálásával is vannak bizonyítékok arra, hogy ezek a gyógyszerek segítenek elpusztítani a tumort kísérő makrofág sejteket, amelyek hozzájárulhatnak a kedvező környezet fenntartásához a rák terjedéséhez.
Ezek az új tanulmányokból származó bizonyítékok arra utalnak, hogy ezeket a gyógyszereket érdemes lehet alkalmazni a hagyományos kemoterápia és immunterápia mellett, mivel látszólag szimbiotikus befolyásuk van egymás hatékonyságára [16].
Ha működik, miért nem használják?
Ezek az új tanulmányokból származó bizonyítékok arra utalnak, hogy ezeket a gyógyszereket érdemes lehet alkalmazni a hagyományos rákkemoterápia és immunterápia mellett, mivel látszólag szimbiotikus befolyásuk van egymás hatékonyságára [16].
Azonban a tanulmányok szerzői gyakran azt sugallják, hogy ennek a megközelítésnek az előnyei csak akkor lesznek elérhetők, amikor új generációs gyógyszerek kerülnek kifejlesztésre – egy folyamat, amely akár 10 évig is eltarthat.
Az ilyen új molekulák vagy ezeknek az adaptációknak a kifejlesztésében részt vevő fő gyógyszeripari szereplők közé tartozik a Bayer, a Pfizer és az Astra Zeneca is, akik remélik, hogy szabadalmaztatják azokat. Azonban átlagosan 13,5 évbe telik egy új gyógyszer piacra hozatalához, és csak körülbelül 7% jut el a betegekhez a klinikai vizsgálatok első fázisától kezdve.
Ez az akadály az aktuálisan elérhető kezelésekhez való hozzáférésben frusztrálja azokat az onkológusokat, akik már új megközelítést próbálnak ki, és szeretnék, ha több kezelőközpont is alkalmazná.
Annak ellenére, hogy jogilag jogosultak a betegeik legjobb érdekében kínált kezeléseket felajánlani, csak kevés onkológus hajlandó követni a “kreatív együttérzés” megközelítését a receptírozásban, és a halálos betegek számára gyakran nehéz olyan orvosokat találni, akik hajlandók lennének ilyen oldalas gondolkodást alkalmazni.
Az érdeklődéssel rendelkező kutatók körében azonban ismert, hogy az Egyesült Királyság Nemzeti Egészségügyi Szolgálata (NHS) onkológiai szakemberei olyan gyógyszereket kínálnak, amelyeket a nyilvánosság elől elrejtenek. Egyesek például magánbeszélgetéseik során arról beszélnek, hogy antivirális valganciclovirt írnak fel az agy- és gerincvelői limfómák kezelésére.
Mások azt mondják, hogy bár tisztában vannak az új kutatási iránnyal és azzal, hogy ilyen kezelés hosszabb életet biztosít, nem alkalmazzák azokat a kollégák kritikája vagy ellenségeskedése miatt, akik ellenzik a elfogadott gyakorlaton túli eltérést.
Egy onkológus még arra hivatkozott, hogy a standard 15 perces NHS konzultációban nincs elegendő idő a kezelés működésének magyarázatára.
Bár a remény az, hogy az észlelési tanulmányok eredményei elegendő meggyőző bizonyítékot nyújtanak majd arra, hogy többen is bevezessék ezeket a gyógyszereket a rutin gyakorlatba, azok, akik az azonnali alkalmazás mellett érvelnek, úgy vélik, hogy sok élet veszélytelenül fog elveszni addig.
Lehet, hogy nem számít, hogy a pontos útvonalakat megértjük-e vagy sem. Ha ezek a kezelések biztonságosak és kedvező hatással vannak, sok beteg, különösen a haldoklók közül, azt mondaná, hogy mindenképpen alkalmazni kellene őket.
Írta: Lois Rogers – szakértő egészség- és tudományos újságíró
Forrás:
-
Flaveny CA, Griffett K, Bahaa El-Dien M et al. Broad anti-tumor activity of a small molecule that selectively targets the Warburg Effect and lipogenesis. Cancer Cell DOI: 1016/j.ccell.2015.05.007 (2015).
-
Harshman LC, Xiaodong W, Nakabayashi M et al. Statin use at the time of initiation of androgen deprivation therapy and time to progression in patients with hormone sensitive prostate cancer. JAMA Oncol. doi:10.1001/jamaoncol.2015.0829 (2015).
-
Wang A, Aragaki AK, Tang JY et al. Statin use and all-cancer mortality: Prospective results from the Women’s Health Intiative. Presented at the 2015 American Society of Clinical Oncology Annual Meeting, Chicago, IL, USA, 29 May–2 June 2015.
-
Zhang P, Li H, Tan X et al. Association of metformin use with cancer incidence and mortality: A meta-analysis Cancer Epidemiology 37, 207–218 (2013).
-
Feng Y, Ke C, Tang Q at al. Metformin promotes autophagy and apoptosis in esophageal squamous cell carcinoma by downregulating Stat3 signaling. Cell Death Dis doi: 10.1038/cddis.2014.59 (2014).
-
Yasmin A, Beauchamp MC, Piura E et al. Induction of apotosis by metformin in epithelial ovarian cancer. Gynecol Oncol 121, 492–498 (2011).
-
Nair V, Sreevalsan S, Basha R et al. Mechanism of Metformin-dependent Inhibition of mTOR and Ras Activity in Pancreatic Cancer: Role of Sp Transcription Factors. J Biol Chem 289: 27692–27701 (2014).
-
Salani B, Marini C, Rio AD et al. Metformin impairs glucose consumption and survival in Calu-1 cells by direct inhibition of hexokinase-II. Sci Rep. doi:10.1038/srep02070 (2013).
-
Zhuang Y, Miskimins WK. Metformin Induces Both Caspase-Dependent and Poly(ADPribose) Polymerase-Dependent Cell Death in Breast Cancer Cells. Mol Cancer Res. 9, 603–615 (2011).
-
Qi XF, Zheng L, Lee KJ et al. HMG-CoA reductase inhibitors induce apoptosis of lymphoma cells by promoting ROS generation and regulating Akt, Erk and p38 signals via suppression of mevalonate pathway. Cell Death Dis. doi: 10.1038/cddis.2013.44 (2013).
-
Zhou P, Cheng SW, Yang R, Wang B, Liu J. Combination chemoprevention: future direction of colorectal cancer prevention. Eur J Cancer Prev 21, 231–240(2012).
-
Malenda A, Skrobanska A, Issat T et al. Statins impair glucose uptake in tumor cells. Neoplasia 14, 311–323 (2012).
-
Fares M, Abedi-Valugerdi M, Hassan M, Potacova Z. DNA damage, lysosomal degradation and Bcl-xL deamidation in doxycycline and minocycline-induced cell death. Biochem Biophys Res Commun 463, 268–274 (2015).
-
Saha V, Kearns P, editors. New Agents for the Treatment of Acute Lymphoblastic Leukaemia. Springer Science & Business Media, 7 May 2011.
-
Doudican NA, Pennell R, Byron S, Pollock P, Liebes L, Osman I et al. Mebendazole in the treatment of melanoma: The role of Bcl-2 in predicting response and enhancing efficacy. Presented at the 2010 American Society of Clinical Oncology Annual Meeting, Chicago, IL, USA.
-
Bracci L, Schiavoni G, Sistigu A, Belardelli F. Immune-based mechanisms of cytotoxic chemotherapy; implications for the design of novel and rationale-based combined treatments against cancer. Cell Death and Differentiation 21, 15–25 (2014).




